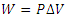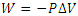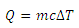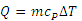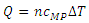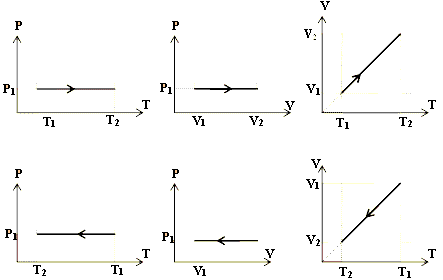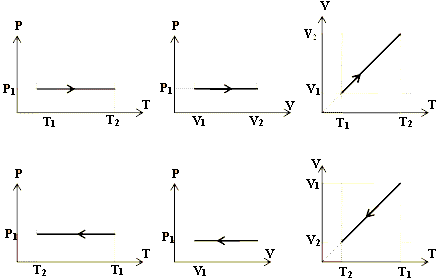فرآیند هم فشار
فرآیند هم فشار فرآیندی ترمودینامیکی است که در آن فشار گاز حین انجام فرآیند ثابت می ماند. برای این كه گاز بتواند فرآیند هم فشار را طی كند، باید پیستون بتواند آزادانه و بدون اصطكاك حركت نماید.
نکته: در فرآیند هم فشار تبادل گرما و كار با محیط وجود دارد.
تغییرات انرژی درونی در این فرآیند برابر با جمع جبری گرما و كار مبادله شده بین سیستم و محیط است.
در فرآیند هم فشار دو حالت زیر ممكن است اتفاق بیفتد:
1- به سیستم گرمای Q داده شود: حجم سیستم زیاد، كار سیستم منفی و انرژی درونی و دمای سیستم زیاد میشود.
2- از سیستم گرمای Q گرفته شود: حجم سیستم كم، كار سیستم مثبت، انرژی درونی و دمای سیستم كم میشود.
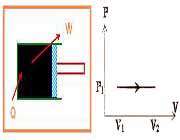
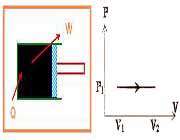
گازی را مطابق شکل زیر داخل استوانه ای که با منبع گرما در تماس است، در نظر بگیریم. گاز ابتدا در فشار P و حجم V1 در حالت تعادل قرار دارد. فرض کنید اصطکاک بین پیستون و استوانه ناچیز است.
در این صورت فشار گاز با محیط برابر است، دمای منبع را اندکی بالا می بریم. به علت اختلاف دمای بین منبع و دستگاه مقدار کمی گرما به گاز منتقل می شود که در نتیجه ی آن گاز کمی منبسط می شود و پیستون را اندکی به سمت راست جا به جا می کند. اگر گرما دادن به گاز را به همین روش به صورت بسیار آهسته ادامه دهیم، گاز به کندی منبسط می شود و پیستون بسیار آهسته به طرف راست حرکت می کند. در این حالت شتاب حرکت پیستون بسیار کوچک خواهد بود، در نتیجه نیرویی که گاز به پیستون وارد می کند باید با نیرویی که محیط به پیستون وارد می کند، برابر باشد. بنابراین می توان گفت که در حین گرما دادن همواره فشار گاز با فشار محیط برابر است؛ یعنی در حین فرآیند فشار گاز ثابت می ماند.
کار انجام شده روی محیط در حین این فرآیند اگر جابه جایی پیستون به اندازه d باشد به صورت زیر به دست می آید:
W=(PA)d
Ad تغییر حجم استوانه است که برابر است با 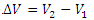 در نتیجه داریم:
در نتیجه داریم:
نکته: با توجه به شکل حاضل ضرب  برابر با سطح زیر نمودار P-V است. این نتیجه برای حالت خاص فرآیند هم فشار به دست آمد ولی در مورد تمام فرآیندها نیز درست است.
برابر با سطح زیر نمودار P-V است. این نتیجه برای حالت خاص فرآیند هم فشار به دست آمد ولی در مورد تمام فرآیندها نیز درست است.
اکنون به محاسبه ی گرمای مبادله شده در فرآیند هم فشار می پردازیم. می دانیم که گرمای لازم برای تغییر دمای یک جسم به اندازه ی 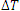 با رابطه ی زیر داده می شود:
با رابطه ی زیر داده می شود:
که باید از گرمای ویژه ی مربوط به فرآیند هم فشار که به صورت زیر تعریف می شود استفاده کنیم که رابطه به صورت زیر در خواهد آمد:
گرمای ویژه ی گاز در فشار ثابت:
گرمای ویژه ی یك گاز در فشار ثابت (cP) برابر است با مقدار گرمایی كه در فشار ثابت به یكای جرم آن داده می شود تا دمای آن یك كلوین بالا رود.
اگر مقدار گاز را بر حسب مول بیان کنیم و به جای m مقدار nM را در رابطه ی بالا قرار دهیم در این صورت گرمای مبادله شده به صورت زیر خواهد شد:
ظرفیت گرمایی مولی در فشار ثابت:
مقدار گرمایی است که در فشار ثابت به یک مول از یک گاز داده می شود تا دمای آن یک کلوین بالا رود.
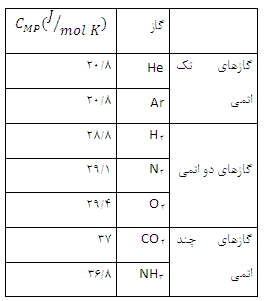
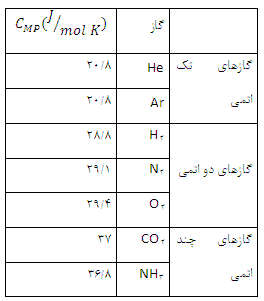
با تقریب خوبی می توان نشان داد كه ظرفیت گرمای مولی درحجم ثابت به جنس گاز بستگی ندارد و برای گازهای تك اتمی برابر 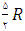 برای گازهای دو اتمی
برای گازهای دو اتمی 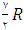 و برای گازهای چند اتمی
و برای گازهای چند اتمی 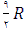 است.
است.
ظرفیت گرمایی مولی چند گاز در فشار ثابت
نمودارهای فرآیند هم فشار:
نکته: نموادار حجم – دمای فرآیند هم فشار خط راست است زیرا شیب آن 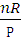 ثابت است که نمونه آن نمودار V-T شکل بالا سمت راست نمودار بالایی و پایینی است. نمودارهای بالا و پایین وسط هم نمودار P – V و نمودارهای سمت چپ نیز نمودار P – T در فشار ثابت هستند که در آن ها به ترتیب تغییرات حجم و تغییرات دما را داریم.
ثابت است که نمونه آن نمودار V-T شکل بالا سمت راست نمودار بالایی و پایینی است. نمودارهای بالا و پایین وسط هم نمودار P – V و نمودارهای سمت چپ نیز نمودار P – T در فشار ثابت هستند که در آن ها به ترتیب تغییرات حجم و تغییرات دما را داریم.
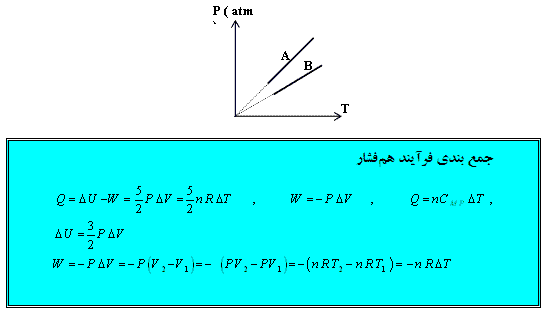
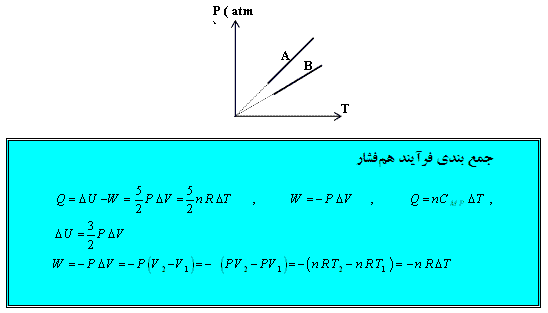
تمرین: نمودار ( P – T ) برای دو گاز كامل تك اتمی كه تعداد مولهایشان برابر است داده شده است حجم كدام گاز بیشتر است؟
لینک های مرتبط:
مرکز یادگیری سایت تبیان
تهیه : فاطمه گودرزی
تنظیم : نسیم گنجی منش